INTRODUCCIÓN
Los Callichthyidae son bagres acorazados que pueden reconocerse fácilmente entre otros
Siluriformes por tener dos series longitudinales de placas dérmicas
en sus flancos (Reis, 1998, 2003).
La familia está actualmente compuesta por más de 200 especies que se agrupan
en ocho géneros, incluyendo Corydoras Lacépède, 1803 con más de 175 especies
válidas, lo que lo convierte en el género
más diverso dentro de la familia y también dentro del orden Siluriformes (Lima & Britto, 2020; Tencatt et al.,
2019). El género tiene una amplia
distribución geográfica en las regiones cisandinas de América del Sur, predominantemente en la cuenca del Amazonas,
donde se encuentran más de la mitad
de las especies conocidas (Tencatt & Ohara,
2016). En Argentina se han descripto 13
especies de Corydoras, en la provincia de Salta se citan un total de cuatro, Corydoras paleatus
Jenyns 1842, C. micracanthus Regan 1912, C. gladysae Calviño
& Alonso 2009 y C. petracinii Calviño
& Alonso 2009, las últimas dos
especies endémicas (Liotta, 2005; Knaack,
2007; Calviño & Alonso, 2009). C. gladysae
habita en humedales
vegetados del río Calchaquí, cuyas aguas han sido caracterizadas como de alta salinidad (Morandini 2014), mientras que C.
petracinii se encuentra en
arroyos secundarios del río San Lorenzo
que registra una baja salinidad.
Los peces
teleósteos que habitan tanto en agua dulce como en aguas salobres
y de mar mantienen la osmolaridad de sus fluidos corporales a un nivel relativamente
constante; la osmolaridad plasmática generalmente se mantiene alrededor
de 300 mOsm kg−1, (Motais
et al., 1969; Evans, 2008). La regulación del agua y los iones en los
peces tiene lugar principalmente en
las branquias, los riñones y el
intestino, creando gradientes iónicos
y osmóticos entre los fluidos corporales y
los ambientes externos. Las branquias son órganos
multifuncionales con una compleja organización
interna similar en la mayoría de los
peses óseos (Wilson & Laurent, 2002); además de realizar el intercambio gaseoso, llevan a cabo otra serie de
funciones criticas como la
ionorregulación, la mantención del balance
ácido-base, la excreción de productos nitrogenados y la destoxificacion (Goss et al., 1998).
En particular las células clorídeas
del epitelio branquial
cumplen un rol fundamental en la osmorregulación (Marshall, 1995; McCormick, 1995) poseen en sus membranas celulares proteínas transportadoras de
iones (Hootman & Philpott, 1979; Hirose et al., 2003) que participan activamente en el equilibrio
iónico del medio interno. Se han observado cambios
morfológicos en las células
clorídeas en respuesta a la salinidad ambiental en varias especies
de teleósteos. En los peces de agua dulce en ambientes
con altas concentraciones de
salinidad, las células de clorídeas
aumentan en número y tamaño (McCormick, 1995; Uchida et al., 2000).
Nos propusimos analizar la organización de las branquias de Corydoras gladysae y C. petracinii y determinar si existen
diferencias en la morfología del epitelio branquial
en relación a las distintas condiciones de salinidad de los ríos en los que habitan.
MATERIALES Y MÉTODOS
Los ejemplares de Corydoras gladysae
fueron capturaron en
humedales vegetados paralelos al
brazo principal del río Calchaquí, a unos 800
metros al sureste del puente de entrada a Cachi;
el cuerpo de agua registró al momento de la captura una conductividad de 1279 µS. C. petracinii fue capturada en
pozones vegetados del río San
Lorenzo, a la altura de Lomas de Medeiros a unos 200 metros al oeste de la Av. Circunvalación Oeste en la
Capital de Salta; al momento de la
captura se registró una conductividad de 176 µS.
Se capturaron siete ejemplares de ambas especies empleando redes atarrayas y copo; se anestesiaron con benzocaína al 0,01%, se sacrificaron por dislocación cervical
y se fijaron en formaldehido estabilizado al 10%. Las branquias
se extrajeron bajo microscopio estereoscópico Olympus SZ61, la serie derecha se procesó en el laboratorio de Microscopía Electrónica de Barrido (LASEM)
de la Universidad Nacional de Salta,
se observaron y fotografiaron con un equipo
Jeol JSM-6480LV a alto vacío, con electrones
secundarios y un voltaje de 15 a 20 kv. La serie izquierda
de las branquias de cada
ejemplar se procesó con técnicas histológicas de rutina (Martoja & Martoja, 1970) en el Laboratorio de Histología Animal, Facultad de Ciencias Naturales-UNSa.
Para determinar la existencia de diferencias en la abundancia y tamaño de las células
clorídeas entre las
especies; en las microfotografías de microscopía
electrónica de barrido (MEB) se trazaron
al azar, áreas de 40 micras cuadradas sobre los filamentos branquiales.
Las observaciones se realizaron en un microscopio Olympus BX40 y fotografiaron con una cámara digital Olympus
DP25 acoplada al microscopio. Los ejemplares analizados para este trabajo
se encuentran depositados en la colección
del laboratorio de Histología de la Facultad
de Ciencias Naturales, Universidad Nacional de Salta.
RESULTADOS
Estructura general
de las branquias
La morfología de las branquias de Corydoras petracinii y C. gladysae responde
al patrón general de los teleósteos, con un arco curvo
desde el cual emergen los filamentos branquiales que sostienen a las laminillas respiratorias. Las branquias
presentan una doble curvatura, describiendo una forma de “S” en vista frontal
al extremo terminal
de los filamentos (Fig. 1A). En vista lateral se diferenció la cara externa
de la interna; la primera
es la superficie de cada arco y sus filamentos branquiales que se posiciona en dirección al opérculo y la cara interna
la superficie de las branquias
que se ordenan hacia el eje
central del cuerpo del pez. Otra región
a destacar es el lado interno entre las dos hileras
de filamentos branquiales de un arco branquial
o el lado interno de las
hemibranquias
(Fig.1B).
Organización histológica
En cuanto
a la organización histológica el arco branquial
se destaca por presentar un soporte de cartílago, rodeado
de tejido conectivo y las arterias aferentes y
eferentes. Del arco branquial irradian
los filamentos que presentan una varilla de cartílago branquial y arteriolas que se capilarizan dentro de las laminillas respiratorias. El arco y los filamentos branquiales están revestidos por epitelio plano estratificado que presenta varios
tipos celulares que tienen una distribución diferente
según la zona que se analice. El arco
branquial está revestido por un epitelio plano estratificado en el que se destaca
la alta densidad de botones
sensoriales que se extienden desde la
base del arco, sobre las protuberancias y hasta los extremos de los filamentos branquiales (Fig. 1C).
Respecto a los
botones sensoriales se han hallado dos tipos morfológicos; botones cónicos
con una base ancha y extremo ahusado
que cubren la superficie
del arco branquial y los
filamentos, y botones fungiformes con una
base angosta y ensanchada en su extremo apical.
Ambos tipos de botones presentan la típica
organización histológica en cebolla de los
botones sensoriales, células acompañantes fusiformes con núcleo basófilo
que se intercalan con neuronas bipolares y órganos en cúpula marcadamente eosinofílicos en el extremo apical (Fig. 2A).
En
cuanto a los tipos celulares
presentes en el epitelio branquial en los cortes
histológicos de los filamentos branquiales se observan
pocas células mucosas y clorídeas, estas se localizan en el epitelio interlamelar. Las células mucosas
redondeadas se caracterizaron por presentar un citoplasma muy claro, con vesículas en su interior
y núcleo basal basófilo; las células clorídeas
de forma redondeada, con un citoplasma marcadamente
eosinófilo y un núcleo basófilo
de posición más o menos central. Las células más abundantes
en los filamentos fueron las pavimentosas componentes del epitelio plano
estratificado. Las laminillas respiratorias en las dos especies
son muy cortas,
en su interior se observan
los capilares alineados sostenidos por células pilar y rodeados de una doble capa de epitelio plano
simple, el epitelio
respiratorio (Fig. 2B).
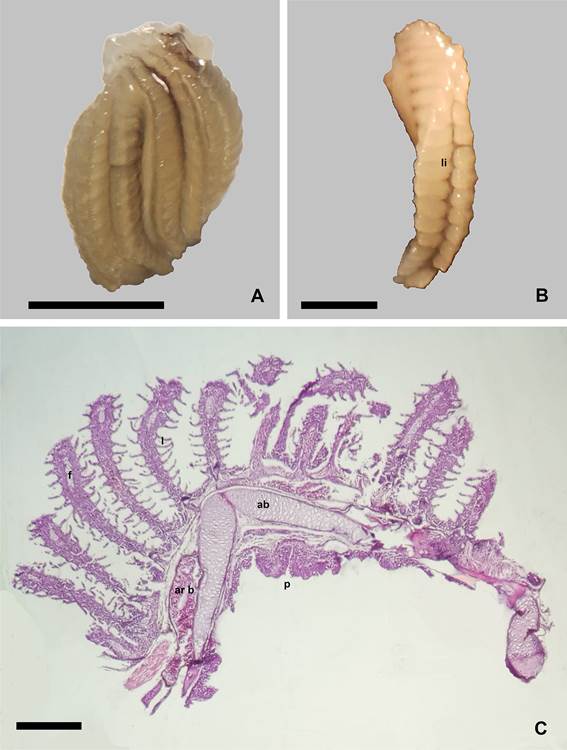
Figura
1.
Aspecto y organización histológica de la branquia de Corydoras gladysae.
A. Vista frontal al extremo terminal
de los filamentos branquiales. B.
Detalle de una branquia donde se aprecia
el lado interno entre las
hemibranquias (li). C. Organización histológica de una branquia, arco de
cartílago (ab), arteria branquial (ar
b), filamentos branquiales (f), laminillas respiratorias (l). protuberancias de
la base del arco (p). Escalas: A: 2mm. B: 1mm. C:
250µm.
Organización de las branquias
El arco branquial
en ambas especies
es curvo y ancho, presentando en el borde basal de
la cara externa cinco a siete protuberancias.
Los filamentos branquiales son
anchos en toda su extensión y las
laminillas respiratorias muy cortas. Las dos especies
presentan numerosos botones
sensoriales, en los filamentos y arcos de las hemibranquias internas
los botones se encuentran cubriendo
toda la superficie, mientras que en las hemibranquias externa
el número de botones sensoriales se reduce considerablemente. Los botones
cónicos y fungiformes se encontraron a lo largo de
los filamentos y su número es mayor en
la cara interna de las branquias,
mientras que los botones fungiformes se diferenciaron claramente por el extremo redondeado a plano, rodeado por
un reborde y solo se hallaron sobre los filamentos branquiales (Fig. 3).
|
|
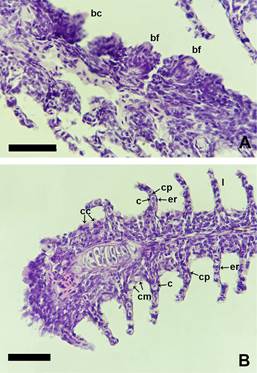 |
Figura 2. Botones
sensoriales y tipos celulares en los
filamentos branquiales de Corydoras gladysae y Corydoras petracinii. A. Corydoras gladysae, con botones fungiformes (bf) y botones
cónicos (bc). B. Corydoras
petracinii, filamento revestido por
epitelio plano estratificado, células clorídeas (cc), células mucosas
(cm), laminillas respiratorias (l) donde se observan
numerosos capilares (c) sostenidos
por células pilar (cp) y rodeados de una doble
capa de epitelio plano simple (er). Escala 50 µm.
En las imágenes de MEB se confirmó que las células mucosas y clorídeas se hallan
sobre el filamento branquial y no
sobre las laminillas. En ambas especies se identificaron en la superficie
de los filamentos, células
epiteliales planas o pavimentosas,
células mucosas, células clorídeas
y células neuroepiteliales. Las células pavimentosas son las más abundantes, presentan formas
poliédricas con microcrestas en su superficie y sus bordes son elevados, poniendo
en evidencia las fuertes uniones celulares (Fig. 4A). Las células
mucosas se presentan como huecos con
rebordes que sobresalen producto del
proceso de exocitosis (Fig. 4B). También las células
clorídeas fueron abundantes en número en ambas especies,
su forma es ovoide
a redondeada, se encuentran rodeadas por
células pavimentosas a las que se hallan fuertemente unidas; su superficie apical presenta una ornamentación característica de aspecto de enrejado con la presencia de pequeñas vesículas. Las células clorídeas se hallaron a lo
largo de todo el filamento, aunque su densidad es mayor en el lado interno de las hemibranquias (Fig. 4C). Un tipo celular que se evidenció únicamente con MEB, corresponde a las denominadas
células neuroepiteliales, estas son
escasas en número y se caracterizan por su forma redondeada con numerosas proyecciones en su interior rodeadas por un reborde sobresaliente de la superficie del epitelio (Fig. 4D).
Abundancia y aspecto de células clorídeas
El
número de células
clorídeas por área entre ambas
especies fue diferente, presentando C. gladysae un
promedio de 22 células y C. petracinii un promedio de 13.
En
cuanto a su aspecto se halló que C. gladysae
posee células clorídeas más grandes, con un promedio de 4,5 µm de ancho y 6,5 µm de largo, mientras que C. petracinii presentó un promedio de 3,6 µm de ancho y 5,5 µm de largo. Las células clorídeas de C. gladysae
mostraron un marcado
reborde y una abundancia
de vesículas en su superficie (Fig. 4E),
mientras que C. petracinii evidenció un
enrejado más ordenado
y sin presencia de vesículas, posiblemente debido a una
menor actividad funcional (Fig. 4F).
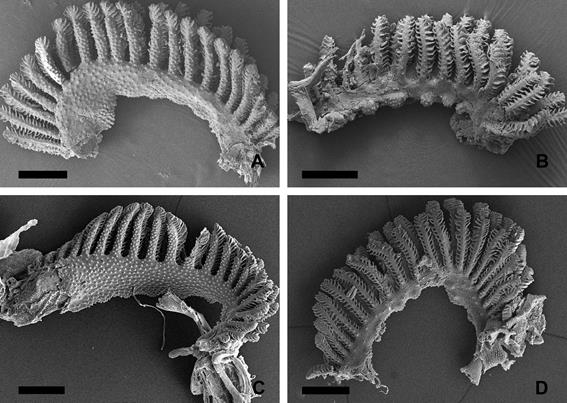
Figura
3.
Aspecto del epitelio branquial de Corydoras gladysae y Corydoras
petracinii al microscopio electrónico
de barrido. A. Detalle de la cara interna de una branquia de C.
gladysae. B. Detalle de la cara externa
de una branquia de C. gladysae. C. Detalle de la cara interna de
una branquia de C. petracinii. D. Detalle de la cara
externa de una branquia de C. petracinii. Escala 500 µm.
DISCUSIÓN
La organización branquial de Corydoras petracinii y C. gladysae responde al patrón general descripto
para la mayoría de los teleósteos (Hibiya, 1982; Olson, 2000; Wilson & Laurent, 2002). La familia
Callychthydae presenta varias especies con respiración aérea confirmada, Hoplosternum thoracatum Hancock 1828, Hoplosternum littorale Hancock
1828 (Graham, 1997), Corydoras paleatus
(Plaul et al., 2021); las branquias de C. petracinii
y
C. gladysae presentaron anchos filamentos branquiales de los que se desprenden laminillas respiratorias
cortas, que en cortes histológicos se
pueden interpretar como atrofiadas, pero la
microscopía electrónica de barrido corroboró su corta extensión, lo que se relaciona posiblemente con
sus hábitos respiratorios aéreos, situación estudiada en C. paleatus por Plaul et al. (2021). La abundante presencia de botones sensoriales que se distribuyen sobre el arco branquial y en los filamentos en ambas especies. Estas estructuras
incrementan en número en la cara interna
de la branquia y en las protuberancias que sobresalen en los arcos branquiales; la presencia de botones sensoriales también ha sido señalada en C. paleatus
pero su número es menor y no llegan a cubrir todo el filamento como en las
especies aquí estudiadas. Los botones
sensoriales, cónicos y fungiformes hallados en C. petracinii y C. gladysae
parecen ser una característica del género;
ninguna de las dos especies presentó branquiespinas
como las descriptas por Plaul et
al., (2021) en C. paleatus. Probablemente los botones sensoriales son botones gustativos que cumplen funciones de palatabilidad, en los
cortes histológicos fue evidente la inervación
de estas estructuras, en otros teleósteos se han encontrado estructuras similares que cumplen este rol, como en Amblypharyngodon melettinus Valenciennes 1844 (Hofer et al., 2003), Astyanax mexicanus De
Filippi 1853 (Bathia et al., 2022).
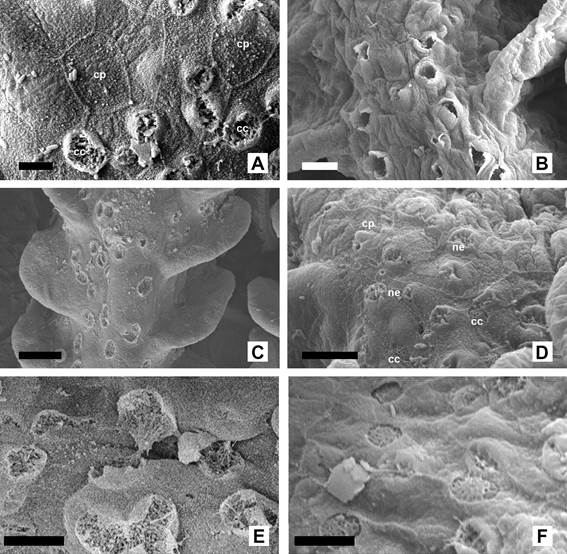
Figura
4.
Células del epitelio branquial de Corydoras gladysae y Corydoras
petracinii. A. Células pavimentosas
de forma poliédrica y con presencia de microcrestas (CP) y células clorídeas
(CC) de C. gladysae. B.
Células mucosas en exocitosis sobre un filamento branquial de C. petracinii.
C. Detalle del lado interno de
un filamento de C. gladysae, se observan numerosas células clorídeas
rodeadas por cé- lulas pavimentosas. D.
Detalle del epitelio del filamento branquial de C. petracinii, se
observan células neuroepiletiales (ne) con numerosas proyecciones, células pavimentosas (CP) y células
clorídeas (CC). E.
Detalle de las células clorídeas en lado interno de las hemibranquias de C.
gladysae. F. Detalle de las células
clorídeas presentes en el lado interno de las hemibranquias de C. petracinii.
Escalas: A: 5µm. B: 10µm. C: 20µm. D: 10µm. E:
5 µm. F: 5µm.
La diversidad de células en el epitelio
branquial que reviste a toda la branquia ha sido ampliamente estudiada en otros
teleósteos, se han reconocido varios
tipos celulares que se distribuyen en
diferentes zonas. Las células epiteliales pavimentosas representaron el mayor porcentaje. Las células mucosas, las pocas que se detectaron, se las observó
sobre la superficie de los filamentos
especialmente en la cara externa de
la branquia. Las células neuroepiteliales
solo pudieron ser observadas con microscopía electrónica de barrido
y se ubicaron sobre los
filamentos de la cara externa. Las células clorídeas
fueron muy escasas en las caras externa e interna de
la branquia, pero muy abundantes en el lado interno de las hemibranquias y en los espacios interlamelares. Las células clorídeas
de ambas especies presentaron una morfología
similar, redondeada a oval, con la
superficie apical de aspecto
enrejado y bordes bien marcados; su aspecto
es similar al descripto por Perry (1997)
para Ictalurus nebulosus Lesueur 1819.
Respecto
al tamaño las células clorídeas en C. gladysae resultaron ser más grandes y numerosas que las de C. petracinii. Plaul et al. (2021) en su descripción del epitelio branquial de C.
paleatus
señala la escasez de estas
células, esto podría deberse a que no
se realizaron observaciones del lado interno de las hemibranquias con MEB, como así también
la magnitud del aumento de las observaciones, ya que estas células rondan
el orden de las cinco micras de diámetro.
En las células clorídeas de los peces de
aguas continentales se han identificado la presencia de proteínas en el sistema
tubulovesicular que intercambian iones de Na+, K+, Ca+2,
H+, HCO3-2, activados con bombas V-Atpasas, de allí la
gran cantidad de mitocondrias (Perry, 1997; Goss et
al., 1998; Wilson & Laurent, 2002; Hirose et al., 2003;
Evans et al., 2005). Los ríos donde viven ambas especies tienen
marcados periodos de creciente y estiaje; en los meses de creciente, diciembre
a mayo, el caudal aumenta por las precipitaciones y el deshielo, y en los meses
de estiaje el caudal desciende marcadamente por lo que los ambientes pueden
registrar un bajo contenido de oxígeno y una mayor concentración de sales
(observación personal). C. petracinii que vive en pozas con escasa
vegetación sube a la superficie frecuentemente, mientras que C. gladysae
habita humedales que se forman luego del periodo de creciente y permanecen como
charcas vegetadas durante la mayor parte del año en condiciones de anoxia e
hipercapnia (observaciones directas a campo).
El mayor número de células clorídeas encontradas en
C. gladysae en comparación con C. petracinii, podría estar
relacionado a los mayores niveles de salinidad de los humedales del río
Calchaquí, que rondan el orden de los 1300 µS, con respecto a los 180 µS del
río San Lorenzo. Morandini (2014) determinó que las aguas superficiales en
diferentes tramos del río Calchaquí son de media a alta salinidad. Azodi et
al. (2021) en un trabajo experimental comprobó en juveniles y adultos de Lates
calcarifer Bloch 1790 que un aumento de la salinidad produce un incremento
en el número de las células clorídeas en los filamentos y espacios
interlamelares, fenómeno observado también en peces eurihialinos (Pisam et
al., 1987; Evans, 2008). Además de la diferencia de concentración de sales
de los dos ambientes estudiados se debe considerar la altura sobre el nivel del
mar, 2300 msnm (río Calchaquí) /1200 msnm (río San Lorenzo) que condicionan la
concentración de oxígeno en el aire y por ende en el agua. El ambiente en el
que vive C. gladysae tiene condiciones de hipercapnia e hipoxia. La
hipercapnia se produce por un aumento de los niveles en sangre del CO2
que se halla como HCO-3, elevando la acidez en sangre; se
ha confirmado que las células clorídeas cumplen un rol fundamental en regular
la acidosis, la regulación iónica, la captación de calcio intraepitelial
(Perry, 1997; Goss et al., 1998). Por ello la presencia de un mayor
número de células clorídeas en C. gladysae podría ser una adaptación al ambiente donde habita, con altas concentraciones de salinidad y condiciones de hipercapnia
e hipoxia.
Varios estudios integrales intentan comprender la taxonomía y la filogenia de las relaciones entre las especies de Corydoras (Alexandrou et al., 2011; Britto, 2003; Nijssen, 1970; Nijssen
& Isbrücker, 1967, 1986); las diferencias encontradas en las células
clorideas y la distribución de los botones gustativos también deberían analizarse en un contexto filogenético para descartar un proceso adaptativo.
CONCLUSION
Las branquias en los peces teleósteos cumplen
un importante rol en la osmorregulación; en ambientes con alta salinidad como el que habita
Corydoras gladysae. En las branquias de esta especie
se encontraron células
clorídeas más grandes
y numerosas que en C. petracinii que
vive en aguas
con baja salinidad
donde su número y tamaño es menor. Las
diferencias en las células clorídeas
entre las especies
muestran una gran plasticidad fenotípica en este órgano
multifuncional.
AGRADECIMIENTOS
Agradecemos a los evaluadores por sus revisiones a la versión definitiva del
trabajo y al Consejo de
Investigación de la Universidad Nacional
de Salta (proyecto A N°2501) por el financiamiento otorgado.
BIBLIOGRAFÍA
Alexandrou, M. A. & M. I. Taylor.
2011. Evolution, ecology
and taxonomy of the Corydoradinae revisited. En Fuller I. A. &
M. Taylor (eds.), Identifying Corydoradinae catfish: Aspidoras, Brochis,
Corydoras, Scleromystax,
C-numbers & CW-numbers: supplement, 1: 101-114.
Azodi M., Bahabadi
M. N., Ghasemi A., Mor- shedi V., Mozanzadeh M. T., Shahraki R., Khademzadeh
O., Hamedi S. & S. Avizhgan. 2021. Efects of salinity on gills’ chloride cells, stress indices,
and gene expression of Asian seabass (Lates calcarifer, Bloch,
1790). Fish. Physiol. Biochem. 47: 2027-2039. https://doi. org/10.1007/s10695-021-01024-6
Bhatia V., de Jesus V. C., Shaik F. A., Jaggupilli A., Singh N., Chelikani P. & D.
Atukorallaya. 2022. Extraoral
expression and characteri- zation of
bitter taste receptors in Astyanax mexicanus (Mexican
tetra fish). FASEB
BioAdvances. 4(9): 574-584.
https://doi. org/10.1096/fba.2022-00032
Britto M. R. 2003. Phylogeny of the subfamily Corydoradinae Hoedeman, 1952 (Silurifor- mes:
Callichthyidae), with a definition of its genera. Proc. Acad. Nat. Sci.
153:119-154. https://doi.org/10.1635/0097-3157(2003)1 53[0119:POTSCH]2.0.CO;2
Calviño P. A. & F. Alonso. 2009. Dos nuevas es- pecies del género Corydoras (Ostariophysi: Siluriformes: Callichthyidae) del
noroeste de Argentina, y la
redescripción de C. mi- cracanthus
Regan, 1912. Rev. Mus. Argent. Cienc. Nat. 11(2):199-214.
Evans D. H. 2008. Osmotic and ionic regulation: cells and animals. CRC Press, Boca Raton, FL.
Evans D. H., Piermarini P. M. & K. P. Choe. 2005.
The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-ba- se regulation, and excretion of
nitrogenous waste. Physiol. Rev.
85:97-177. https://doi. org/10.1152/physrev.00050.2003
Goss G. G., Perry S. F., Fryer J. N. & P. Laurent. 1998. Gill morphology and acid-base regu- lation
in freshwater fishes.
Comp. Biochem. Physiol.
A, Mol. Integr. Physiol. 119(1):
107-115. https://doi.org/10.1016/S1095-
6433(97)00401-7
Graham J. B. (ed.). 1997. Air Breathing Fishes: evolution, diversity, and adaptation. Aca- demic Press, San Diego, California, USA.
Hibiya T. (ed.). 1982. Atlas of fish histology.
Kodansha Ltd. Tokyo.
Hirose S., Kaneko T., Naito N. & Y. Takei. 2003. Molecular
biology of major
compo- nents of chloride cells. Comp. Biochem.
Physiol. B, Biochem.
Mol. Biol. 136(4):
593-620. https://doi.org/10.1016/S1096-
4959(03)00287-2
Hofer R., Salvenmoser W. & F. Schiemer. 2003. Regulation of diurnal filter feeding by a novel gill structure in Amblypharyngodon melettinus (Teleostei, Cyprinidae). Zoo-
morphology. 122: 113-118.
https://doi. org/10.1007/s00435-003-0076-1
Hootman S. R. & C. W. Philpott. 1979. Ultracyto- chemical localization of Na+,
K+-activated ATPase in chloride
cells from the gills of a euryhaline
teleost. Anat Rec. 193: 99-130. https://doi.org/10.1002/ar.1091930107
Knaack J. 2007. Beiträge zur Kenntnis der Callichthyidae (Teleostei: Siluriformes).
III. Corydoras
longipinnis sp. n.–ein neuer Panzerwels aus dem río Dulce in Argentinien (Teleostei:
Siluriformes: Callichthyidae). Vertebr. Zool. 57(1): 35-55.
Lima F. C. T. & M. R. Britto. 2020. A new Corydoras (Ostariophysi: Siluriformes: Callichthyidae) with an unusual
sexual dimorphism from the rio Juruena basin, Brazil.
Zootaxa, 4742: 518-530. https://doi. org/10.11646/zootaxa.4742.3.6
Liotta J. 2005. Distribución geográfica de los pe- ces de aguas continentales de la República Argentina.
Marshall W. S. 1995. Transport processes in isola-
ted teleost epithelia: Opercular epithelium and urinary bladder. En Wooods T. J. & T. J. Shuttleworth (eds.), Cellular and
Molecular Approaches to Fish Ionic
Regulation. Fish Physiol. 14:
1-23. https://doi.org/10.1016/ S1546-5098(08)60240-X
Martoja R. & M. Martoja. 1970. Técnicas en his- tología animal. Pierson. Torray – Masson S.A.
McCormick S. D. 1995. 11. Hormonal control of gill Na+, K+-ATPase and chloride cell func-
tion. In: Cellular and Molecular
Approaches to Fish Ionic
Regulation. Fish Physiol. 14: 285-315. https://doi.org/10.1016/S1546-
5098(08)60250-2
Morandini J. L. 2014. Caracterización de los sistemas de riego de los valles Calchaquíes. FAO- INTA. 299pp.
Motais R., Isaia J., Rankin J. C. & J. Maetz. 1969. Adaptive changes of the water permeability of the teleostean gill epithelium in relation to external salinity.
J. Exp. Biol.
51(2): 529- 546. https://doi.org/10.1242/jeb.51.2.529
Nijssen H. &
I. J. H. Isbrücker. 1967. Notes on the
Guiana species of Corydoras Lacépè- de,
1803, with descriptions of seven new species
and designation of a neotype for Corydoras punctatus (Bloch, 1794) (Pisces,
Cypriniformes, Callichthyidae). Zool. Me- ded. 42: 21-50.
Nijssen H. & I. J. H. Isbrücker. 1986. Review of the genus Corydoras from Peru and
Ecua- dor (Pisces, Siluriformes, Callichthyi- dae). Stud. Neotrop. 21: 1-68. https://doi. org/10.1080/01650528609360697
Nijssen H. 1970. Revision of the Surinam catfishes of the genus Corydoras Lacépède, 1803 (Pisces, Siluriformes, Callichthyidae). Beaufortia. 18:1-75.
Olson K. R. 2000. Respiratory System. In: The laboratory fish. Pp. 357-367.
https://doi. org/10.1016/B978-012529650-2/50027-5
Perry S. F. 1997. The chloride cell: structure and function in the gills of freshwater
fishes. Annual Review of Physiology. 59(1): 325-
347. https://doi.org/10.1146/annurev.phy- siol.59.1.325
Pisam M., Caroff, A. & A. Rambourg. 1987. Two types of chloride cells in the gill
epithelium of a freshwater‐adapted euryhaline fish: Lebistes reticulatus; their modifications during adaptation to saltwater. Am.
J. Anat. 179(1): 40-50. https://doi.org/10.1002/ aja.1001790106
Plaul S. E., Díaz, A. O. & C. G. Barbeito. 2021. Gill morphology and morphometry of the facultative air‐breathing armoured
catfish, Corydoras paleatus,
in relation on aquatic respiration. J.
Fish Biol. 99(4): 1318-1327. https://doi.org/10.1111/jfb.14837
Reis R. E. 1998. Anatomy
and phylogenetic analysis
of the neotropical callichthyid catfishes
(Ostariophysi, Siluriformes). Zool. J. Linn. 124: 105-168. https://doi.or- g/10.1111/j.1096-3642.1998.tb00571.x
Reis R. E. 2003. Family Callichthyidae (armored catfishes). En Reis, R.E., S.O. Kullander
& C.J. Ferraris
(eds.), Checklist of the freshwater fishes of South and Central
América.Pp. 291-309. EDIPUCRS,
Porto Alegre, Brazil,
Tencatt L. F. C., Lima F. C. T. & M. R. Britto. 2019. Deconstructing an octogenarian mis- conception reveals the true Corydoras
ar- cuatus Elwin 1938
(Siluriformes: Callich- thyidae) and
a new Corydoras species from the
Amazon basin. J. Fish Biol. 95: 453- 471. https://doi.org/10.1111/jfb.13980
Tencatt, L. F. C. & W. H. Ohara. 2016. Two new species
of Corydoras Lacépède, 1803 (Siluriformes:
Callichthyidae) from the rio Madeira
basin, Brazil. Neotrop. Ichthyol. 14: 139-154. https://doi.org/10.1590/1982-
0224-20150063
Uchida K., Kaneko T., Miyazaki H., Hasegawa S. &
T. Hirano. 2000. Excellent salinity tolerance of Mozambique tilapia (Oreochromis mossambicus): elevated
chloride cell activity in the branchial and opercular epithelia of the fish
adapted to concentrated seawater. Zool. Sci. 17(2): 149-160. https://doi.org/10.2108/ zsj.17.149
Wilson J. M. & P. Laurent. 2002. Fish gill morpho- logy: inside out. J. Exp. Zool.
293(3): 192- 213. https://doi.org/10.1002/jez.10124