INTRODUCCIÓN
Los ciclos de vida complejos se caracterizan por grandes cambios
morfológicos y/o ecológicos en el transcurso de la ontogenia (Benesh, 2016). Los digeneos (Platyhelminthes: Trematoda) presentan
este tipo de ciclo, con una secuencia de estadios larvales
únicos muy diferentes en cuanto a morfología y ecología:
miracidios, esporoquistes, redias, cercarias
y metacercarias, pudiendo faltar redias y/o metacercarias en algunos
grupos (Galaktionov &
Dobrovolskij, 2003).
La inmensa
mayoría de las especies utiliza un vertebrado como hospedador definitivo, en el que se desarrollan los adultos y producen descendencia a través de la reproducción sexual, liberando al ambiente los huevos dentro de los que se desarrolla el miracidio (Bush et al., 2001). Los miracidios, en los
gasterópodos o bivalvos que actúan como
hospedadores intermediarios primarios, originan
esporoquistes y posteriormente redias; ambos con la capacidad
de producir asexualmente nuevos esporoquistes o redias,
que aumentan la carga parasitaria del molusco.
Los esporoquistes (si la especie
no produce redias) o las redias generan numerosas cercarias, que abandonan al molusco y que,
según el grupo al que pertenecen, pueden ingresar activamente al hospedador definitivo y diferenciarse en adultos o enquistarse como metacercaria en el
ambiente o en un hospedador intermediario
secundario. Si un vertebrado adecuado
consume las metacercarias enquistadas, éstas originan
los adultos (Ruiz, 1952, Cribb et
al., 2003).
Las cercarias pueden pertenecer a especies autogénicas o alogénicas; las primeras
completan su ciclo vital
en un mismo ambiente, generalmente ambientes acuáticos, con lo que los hospedadores intermediarios y definitivos se encuentran confinados al agua, siendo los
peces los típicos hospedadores definitivos; las especies alogénicas, en cambio, desarrollan su ciclo vital utilizando hospedadores acuáticos y terrestres; las aves y los mamíferos constituyen los hospedadores definitivos más comunes (Esch et al., 1998).
A
pesar de la gran cantidad
de información que pueden brindar los ciclos parasitarios, ya que los distintos estadios de digeneos
aportan información sobre los hospedadores, las redes tróficas, la epidemiología de enfermedades de importancia médica y veterinaria, la estructura y los cambios de las comunidades
y diversos atributos de los ecosistemas, es pobre
el conocimiento que se tiene de ellos (Olson & Tkach, 2005, Faltýnková et al., 2008,
Choudhury et al., 2016, Blasco
Costa & Poulin,
2017).
Por otro lado, una especie de digeneo sólo será totalmente conocida
si se conocen
las particularidades morfológicas y ecológicas de las distintas fases de su ciclo vital (Blasco
Costa & Poulin, 2017). Históricamente las cercarias
han sido el estadio
larval más estudiado debido a la gran cantidad
de ejemplares liberados al agua diariamente por los moluscos hospedadores, aun con el inconveniente de su corta vida (48 a 72 h), la necesidad de observar in
vivo su morfología y la ausencia
de caracteres diagnósticos relacionados con los sistemas reproductivos, con lo que la identificación a nivel específico, genérico o incluso de familia
es dificultosa (Ostrowski de Núñez, 1992, Galaktionov &
Dobrovolskij, 2003, Huguenin
et al., 2019).
Los estudios experimentales referidos
a la
transmisión de cercarias
proporcionan información sobre aspectos ecológicos o epidemiológicos, contribuyen a elucidar o corroborar ciclos
vitales y permiten
evaluar la aptitud de ciertas especies
hospedadoras frente a determinadas especies parásitas (Poulin, 2010).
Con el advenimiento de las técnicas
de PCR (reacción en cadena
de la polimerasa) se pueden complementar los estudios experimentales con la amplificación y secuenciación de marcadores moleculares, es decir regiones conservadas de ADN nuclear (ITS 1, ITS 2, 18S y 5.8S son las más utilizadas) o mitocondrial (CO1) de
larvas y/o adultos, para comparar
entre las secuencias obtenidas de distintos
estadios con datos disponibles en GenBank
(Pérez-Ponce de León et al., 2016). Esto ha hecho posible
identificar géneros y especies
y corroborar o dilucidar ciclos vitales con mayor precisión
y rapidez (Nolan & Cribb, 2005, Blasco Costa et al., 2016).
En Argentina Merlo et al., (2021) sistematizaron la información referida a cercarias y metacercarias reportadas en cuerpos acuáticos
continentales de Argentina
durante los últimos
cien años, mencionando los hospedadores intermediarios y definitivos, en caso de haber sido indicados
en los trabajos originales. Sin embargo, hay reportes –entre
ellos algunos de Salta-
que no cuentan con descripciones detalladas de las larvas.
El presente trabajo intenta
complementar la información publicada por Merlo et al., (2021), detallando la morfología y ecología
de 3
morfotipos de cercarias
emergidas naturalmente de los gasterópodos pulmonados Biomphalaria tenagophila y B. orbignyi
en ambientes acuáticos de Salta. Se incluyen los estadios precercarianos que las producen
y los resultados de infecciones experimentales en las que se examinó la competencia de distintos animales
frente a la exposición de dichas
cercarias y al desarrollo de metacercarias.
MATERIALES Y MÉTODOS
Los hospedadores intermediarios primaries B. tenagophila y B. orbignyi se recolectaron en los embalses Campo
Alegre a 29 km al norte
de la ciudad de Salta, (24º34’28’’ S - 65º21’54’’ O) y Puerta de Díaz, a 67 km al sur de la ciudad de Salta, (25º16’16’’ S - 65º31’26’’ O) y en un charco formado
por el aporte de una acequia
en la
zona de Tres Palmeras,
al suroeste de la ciudad de Salta
(25º16’16’’ S - 65º31’26’’
O).
Los gasterópodos se capturaron durante
los años 2004 a 2014 con tamices
de abertura de malla de
1 mm. En el trienio 2005-2007 se realizaron muestreos
sistemáticos realizados durante 1 hora y abarcando las cuatro estaciones del año. Los demás muestreos fueron esporádicos. Se contó con permisos de la Secretaría de Medio Ambiente
y Desarrollo Sustentable de la Provincia de Salta.
Los gasterópodos se trasladaron envueltos
enpapelhúmedoallaboratorioysemantuvieron en recipientes individuales con agua declorada y alimentados con lechuga.
Durante 7 días se observó
el agua bajo lupa para detectar las cercarias emergidas; posteriormente se disecaron
todos los gasterópodos para detectar otros estadios
larvales de digeneos.
La morfología y comportamiento de las cercarias se estudió
in vivo.
Se utilizó solución
de tylosa y los colorantes vitales azul nilo y
rojo neutro. Las mediciones de las estructuras se realizaron con ocular micrométrico sobre cercarias fijadas
en formol 4% caliente. Los esporoquistes y redias y las metacercarias
desenquistadas con finas agujas o con tripsina en medio alcalino a 37 °C se estudiaron de manera similar a las cercarias. La cantidad de ejemplares medidos se expresa como N. La
longitud y el ancho (L x A)
se
expresan en micrómetros (µm) con la media seguida
de la mínima y máxima
entre paréntesis.
Para establecer la aptitud de distintos animales
como hospedadores intermediarios secundarios se expusieron cercarias
recién emergidas
a los posibles hospedadores en recipientes individuales y se los examinó al cabo de 24 h y días subsiguientes.
Los animales utilizados en las exposiciones se criaron
en laboratorio o se capturaron de sitios en los que no había poblaciones de planórbidos y se mantuvieron en laboratorio hasta los experimentos de infección. En cada
caso se indica la cantidad de días transcurridos postexposición (PE), es decir desde la
exposición del hospedador a las cercarias
hasta su disección.
La prevalencia (proporción de individuos
parasitados por un taxón parásito
en la muestra de gasterópodos) se calculó
según Bush et al., (1997) para las muestras
obtenidas durante 2005 a 2007.
Los helmintos se depositaron en la colección del IEBI (Instituto para el estudio de la biodiversidad de invertebrados),
Facultad de Ciencias Naturales, Universidad Nacional de Salta.
RESULTADOS
Clase Trematoda
Rudolphi, 1808 Subclase Digenea Carus,
1863 Orden Plagiorchiida La Rue, 1957
Superfamilia Echinostomatoidea Looss, 1899 Fam. Echinostomatidae Looss, 1899
Gén. Cf. Drepanocephalus Dietz, 1909 Cf. Drepanocephalus sp.
Hospedador: Biomphalaria tenagophila
Sitios: charco de Tres
Palmeras, embalse Campo
Alegre
Prevalencia: 0,03% (2:2864) en charco
Tres Palmeras; 0,8% (5:638) en embalse Campo Alegre
Redias (Fig. 1A): N=12 ejemplares provenientes de infecciones naturales. Redias de intenso color
amarillo, 2070 (1728-2419) x 235 (171-317) con un par de apéndices locomotores posteriores; faringe fuerte, 49 (42-66) x 60 (47-78); ciego bien desarrollado
que sobrepasa la mitad del cuerpo.
Contienen hasta 3 cercarias
maduras y varias masas germinales. Se ubican
en la glándula digestiva, aunque
también se las encontró
sobre otros órganos
como tubo digestivo
y uréter en infecciones masivas.
Cercarias (Fig. 1B-C): N=20 cercarias
emergidas de B. tenagophila, de Campo Alegre. Tipo echinocercarias. Cuerpo: 358 (314-412) x 178 (147-216). Tegumento grueso,
cubierto de pequeñas
espinas; seis pares de pelos sensitivos, ubicados
lateralmente, entre la faringe y el nivel posterior de la ventosa ventral; collar cefálico de espinas formado por 27 espinas: 4 espinas angulares
de cada lado de 16-19, 5 laterales a cada lado de 7-8 en una hilera
y 9 espinas centrales de 13-16
dispuestas en dos hileras. Ventosa oral de 43 (39-47) x 40 (29-49);
ventosa ventral un poco más grande que la oral, 52 (44-59) x 59 (49-
66), ambas con bordes festoneados. Prefaringe presente,
corta, con tres pares
de glándulas prefaringeales alargadas; faringe pequeña, de 28 (22-34) x 17 (15-22), seguida de un largo esófago
septado y granulado. Los ciegos, bien desarrollados y de contenido granular, se
bifurcan a nivel
del borde anterior de la ventosa
ventral y llegan hasta el extremo
posterior del cuerpo.
Ocho glándulas de penetración desembocan en el borde anterior de la ventosa
oral. Glándulas cistógenas con contenido en barras. Fórmula
flamígera: 2(3+3+3+3+3) =30 y 6-9 flamígeras intercalares. Conductos
principales de los canales excretores con 21- 29 gránulos de entre 7 y 17 µm de diámetro, de paredes gruesas.
Vesícula excretora
con una pequeña cámara
anterior que conecta con los conductos excretores principales anterolateralmente
y una cámara posterior más grande que conecta con el canal excretor que desemboca en el extremo de la cola. Cola de
mayor longitud que el cuerpo, 628 (560-668) x 55 (49-59), sin velos natatorios. Relación L cola: Lcuerpo: 1,76 (1,50-1,91).
Comportamiento: Emergen durante la noche. Fototactismo positivo. Sobreviven 24 horas.
Infecciones experimentales: Se expusieron cercarias a 18 renacuajos
(Rhinella sp., Pleurodema borelli), a 6 peces (2 madrecitas Jenynsia sp, y 4 mojarritas, Astyanax sp.) y a 10 ejemplares de B. tenagophila. Se hallaron metacercarias en renacuajos y peces a 2 y 4
días PE; no penetraron en los moluscos.
Metacercarias (Fig. 1D-F): N=30 quistes
recuperados de renacuajos infectados experimentalmente
4 días PE. Quistes ovales,
de pared delgada, 192 (147-226)
x 142 (167- 118). En la metacercaria se distinguen las dos ventosas, la faringe, esófago y ciegos desarrollados, los corpúsculos refringentes de 11 (10-15)
de diámetro y el collar de grandes
espinas, en número de 27, de 22 (15-27); son visibles
además las glándulas prefaringeales. En peces los quistes (N=3) hallados en las
branquias aparecen más grandes: 224 x 172.
Infecciones experimentales: Metacercarias obtenidas experimentalmente en renacuajos se administraron a 3 ratones (Mus musculus), 3 patitos
(Anas platyrhynchos) y 2 pollitos (Gallus domesticus). A 3, 6 y 12 días PE no se encontraron adultos.
Comentarios: La familia
Echinostomatidae es
cosmopolita y muestra una gran diversidad;
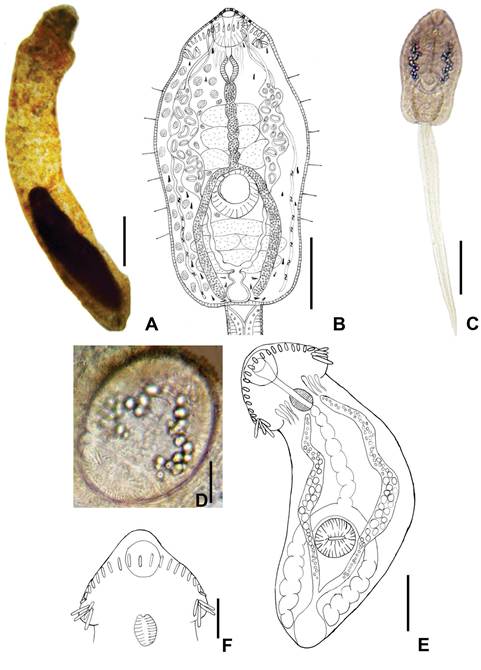
Figura 1. Cf. Drepanocephalus sp. A. Redia in vivo. B. Cuerpo de la cercaria. C. cercaria, in vivo,
en posición de reposo. D. Quiste in vivo obtenido de
infección experimental en ejemplares
de
Astyanax sp. E. Metacercaria. F.
Detalle de la corona de espinas.
Escalas: A, C: 200 µm; B, E: 100 µm; D, F: 50 µm.
comprende 10 subfamilias y 44 géneros
(Tkach et al. 2016), aunque
hay confusión en la sistemática porque hay homogeneidad interespecífica de caracteres y porque la diagnosis diferencial entre especies es pobre
en los nuevos taxa descriptos (Toledo et al., 2009).
Las cercarias del presente
estudio son identificadas como cf. Drepanocephalus por tener
27 espinas, de las cuales
las 2x4 angulares son mucho más grandes que las restantes, ventosas rodeadas por un borde con
crestas, ausencia de saco prefaríngeo y por enquistar en peces y larvas de anfibios.
Los ciclos conocidos de Drepanocephalus son alogénicos, tienen 3 hospedadores, con pulmonados planórbidos, peces o anfibios
y aves piscívoras -Phalacrocorax y Sula- en América.
(Yamaguti, 1971;
Kostadinova, 2005, Pinto et al. 2015, Tkach
et al. 2016). Pinto et al., (2015) caracterizan morfológica y molecularmente 2 morfotipos de cercarias y redias procedentes de B. straminea de Brasil y parte de sus ciclos vitales, que resultan muy semejantes a lo encontrado en este estudio,
identificándolos como D.
auritus y Drepanocephalus sp. y, al igual que en el caso aquí descripto fallaron
en obtener los adultos experimentalmente; sin embargo,
la cercaria encontrada
en Salta presenta 3 pares de glándulas prefaríngeas, ausentes en ambos morfotipos de Brasil.
En Argentina
cercarias similares
a la aquí estudiada fueron reportadas por Ostrowski
de Núñez et al.
(1991) emergida
de B. occidentalis en Corrientes y por Martorelli (2003)
emergida de B. tenagophila y B. straminea en
Uruguay, pero ambas tienen
tegumento sin espinas, 28 pares de células flamígeras y la primera presenta
cuerpo prefaríngeo formado por gránulos refráctiles, por lo que a la luz de los conocimientos actuales pertenecerían al género Petasiger (Tkach et al., 2016). Se ha registrado a Drepanocephalus spathans y
otros adultos con 27
espinas: Petasiger segregatum (Paryphostomum segregatum) y P. fragosum
en Phalacrocorax brasilianus (Ostrowski de Núñez, 1968); esta especie de ave es común en ambientes acuáticos
de Salta, por lo que podría
actuar como hospedador definitivo.
Clase Trematoda
Rudolphi, 1808
Subclase Digenea Carus, 1863
Orden Plagiorchiida La Rue, 1957
Superfamilia Echinostomatoidea Looss, 1899
Fam. Echinostomatidae Looss, 1899
Género Neopetasiger Baschkirova, 1941
Neopetasiger sp.
Hospedadores: Biomphalaria tenagophila y
B. orbignyi
Sitio: embalse Campo Alegre y embalse Puerta de Díaz
Prevalencia: 0,31% (2:638) en embalse
Campo Alegre;
0,32% (3:943) en embalse
Puerta de Díaz.
Redias (Fig. 2A): N=10. Redias procedentes de ejemplares de B. tenagophila del embalse Campo Alegre, 861 (697-1080) x 166 (137-206). Faringe de 76 (59-98); el ciego se extiende hasta 504 (393-609). El collar cefálico se sitúa a un tercio del borde anterior y los apéndices locomotores posteriores a dos tercios. Las redias contienen hasta nueve cercarias maduras y
hasta 34 masas germinales. Se ubican sobre la gónada y glándula digestiva del hospedador.
Cercarias (Fig. 2B-C): N=10. Cercarias tipo magnacauda (con cola muy larga) emergidas
de ejemplares de B. orbignyi del embalse Puerta de Díaz. Cuerpo 139 (123-159) x 47 (34-69).
Tegumento con espinas. Tres pares
de pelos sensitivos, un par a la altura de la ventosa
oral; un par lateral
a la altura del borde anterior de la ventosa
ventral y un par posterior
a la altura de la vesícula
excretora. Collar
de 19 espinas, 2x4 angulares
y 11 centrales en una fila ininterrumpida. Ventosa oral de 26 (25-29) x 25 (25-29). Ventosa ventral
de 30 (25-34) x 28 (25-32).
Prefaringe corta; faringe de 14 (12-15)
x 3, con pigmentación amarilla
en el lumen; esófago largo, que se bifurca
antes de la ventosa ventral
formando dos ciegos
que sobrepasan el borde posterior de la ventosa
ventral. Numerosas glándulas
cistógenas de contenido en barra
distribuidas por todo el
cuerpo. Primordio
genital posterior a la ventosa
ventral; vesícula excretora
bicameral, la cámara anterior más pequeña recibe
anterolateralmente los conductos excretores; la cámara posterior se continúa con una gran cámara en la cola.
Hay 13-24 gránulos de 5 (2-7)
de diámetro en los conductos excretores principales. Se observaron 8 pares de células flamígeras, aunque podrían ser más, ya
que la gran cantidad de células cistógenas impide localizarlas con claridad; hay además
flamígeras intercalares. Cola muy larga, 1054 (982-1129) x 109 (93-125),
con notorios músculos
circulares y longitudinales. Relación
longitud de la cola:longitud del cuerpo de 8
(7-9). Cercarias emergidas de ejemplares de B. tenagophila de Campo Alegre (N=17):
cuerpo de 164 (113-193)
x 55 (39-64); ventosa oral 27 (25-37)
x 28 (25-37), ventosa ventral 29 (20-37) x 28 (20-32); cola: 524
(412- 707) x 78 (44-103). Relación
longitud de la cola:longitud del cuerpo de 3 (2-4).
Comportamiento. Emergen en horas de la noche y primeras
de la mañana. Muestran fototaxismo positivo. Nadan con un movimiento
ondulante en forma de “S”. En reposo permanecen fl verticalmente con el cuerpo hacia arriba y la cola en línea recta con respecto
al cuerpo.
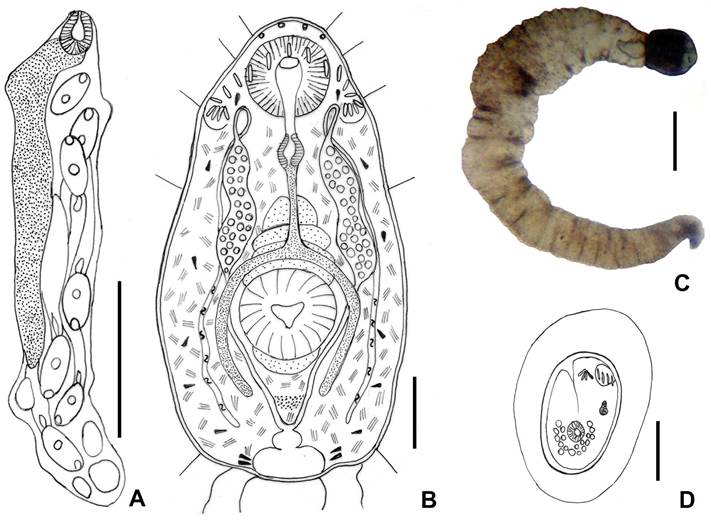
Figura 2. Neopetasiger sp. A. Redia. B. Cuerpo de la cercaria. C. Cercaria de Biomphalaria orbignyi in vivo. D. Metacercaria enquistada. Escalas: A, C:
200 µm; B: 25 µm; D:
50 µm.
Infecciones experimentales. Se expusieron cercarias emergidas de B. tenagophila y B. orbignyi
a 10 ejemplares de Astyanax sp., 7 de Apistogramma borellii y
7 de Bryconamericus thomasi. En
todos los casos
las cercarias fueron ingeridas por los peces y las metacercarias se enquistaron en la faringe
y el esófago y en menor
cantidad en las branquias.
Metacercarias (Fig. 2D): N=20. Los quistes experimentales recuperados a partir de cercarias procedentes de ejemplares de B.
orbignyi del embalse Puerta de Díaz (N=20)
son de forma oval,
83 (91-76) x 51 (76-42), con un espesor
de la pared quística de 2 (3-5) y de la pared secretada por el hospedador de 12 (7- 20). Los quistes obtenidos experimentalmente a partir de cercarias emergidas de ejemplares de B. tenagophila del embalse Campo Alegre (N=20) midieron 95 (86-100) x 59 (49-66), con espesor la pared del quiste de 12 (7-17) y
de la pared reaccional del hospedador de 19 (12-22).
Infecciones
experimentales. Se administraron los quistes
obtenidos experimentalmente a 3 patitos (A.
platyrhynchos), 1 pollito
(G. domesticus), 5 canarios (Serinus canarius), todos
ellos con resultado negativo a los 5, 12,
17 y
18 días PE.
Comentarios.
Las cercarias
son asignadas a Neopetasiger, siguiendo
a Tkach et al., (2016), quienes, sobre la base de un estudio
integrativo de miembros
de la familia Echinostomatidae
reagrupan a las especies de Petasiger con 19 espinas en el género Neopetasiger, cuyas especies
con ciclos conocidos poseen cercarias magnacaudas, sin saco prefaríngeo y emplean una ruta trófica
para la infección al segundo
hospedador intermediario, caracteres presentes en las cercarias
aquí estudiadas. Las especies
de Neopetasiger son alogénicas, con 3 hospedadores. Los adultos se hallan en el intestino de aves piscívoras; las cercarias se desarrollan
en gasterópodos planórbidos y las metacercarias en esófago y faringe de teleósteos
dulceacuícolas (Faltyínková et al., 2008). El género tiene distribución cosmopolita (Nasincová et al., 1994).
Las especies con distribución neotropical N. novemdecim (Lutz, 1928), N. combesi (Zamparo, Overstreet y Brooks, 2005) y N. argentinensis (Lunaschi y Drago 2010) han sido reportadas de aves podicipodiformes (Zamparo, et al.,
2005; Faltýnková et al., 2008; Lunaschi y Drago 2010, Pinto et al 2013), algunas
de cuyas especies
se encuentran en los embalses Campo Alegre
(Podiceps rolland, P. major, Podylimbus podiceps) y Puerta
de Díaz (Monasterio de Gonzo et al., 2008).
En la Región
Neotropical el único ciclo conocido es el de N. novemdecim y su sinónimo
N. caribbensis que
fue completado experimentalmente (Nasir et al., 1972,
Nassi, 1980).
Las cercarias de Neopetasiger sp. aquí descriptas presentan
diferencias morfo- métricas con otras cercarias
del género procedentes de gasterópodos de varias
especies de Biomphalaria de América del Sur, entre ellas el tamaño
del cuerpo y de la cola y la proporción entre ambas medidas;
también hay diferencias entre redias y metacercarias
(ver Pinto et al., 2013). Hay también
dife- rencias morfométricas entre las cercarias encontradas en ambos embalses de Salta. Las diferencias, sin embargo, no son concluyentes para establecer si las cercarias
son o no conespecíficas, ya que podrían
ser variaciones debidas a la utilización de distintas especies hospedadoras intermediarias primarias o a distintos procedimientos de fijación. Son necesarios estudios
moleculares para clarificar la identidad taxonómica de las cercarias de Neopetasiger.
Clase Trematoda
Rudolphi, 1808
Subclase Digenea Carus, 1863
Orden Plagiorchiida La Rue 1957
Superfamilia Plagiorchioidea Lühe, 1901
Familia Cephalogonimidae Looss, 1899
Género cf. Cephalogonimus
Cf. Cephalogonimus sp.
Hospedador: Biomphalaria tenagophila
Sitio: charco
de Tres Palmeras
Prevalencia:
0,4% (11:2864)
Esporoquistes (Fig. 3A): N=5. Alargados, de color naranja-rojizo intenso, 984 (714-1375) x 122 (80-141),
con 10-14 cercarias inmaduras, 2-3 maduras y algunas masas de células germinales; contienen
algunas metacercarias propias enquistadas. Se ubican
en la glándula digestiva del caracol.
Cercarias (Fig. 3B-C): N=20. Tipo xifidiocercarias (cercarias con estilete). Tegumento grueso cubierto densamente con espinas. Cuerpo
de 209 (162-240) x 70 (47-
90). Seis pares de pelos sensitivos: dos pares anterolaterales a nivel de la ventosa oral, dos laterales –entre el nivel de la
faringe y la ventosa ventral- y dos posterolaterales, a nivel de la vesícula excretora. Ventosa oral de 42 (37-45) x 41 (37-45).
Ventosa ventral
de 43 (30-47) x 41 (35-45). Estilete
simple, delgado,
con bulbo basal, de 16 (15-17)
x 5. Prefaringe presente,
faringe desarrollada, esófago corto,
ciegos intestinales septados
que superan apenas el borde posterior de la ventosa
ventral. Siete pares de glándulas
de penetración, anterolaterales a la ventosa ventral; sus conductos
desembocan cerca del extremo
anterior del estilete. Glándulas cistógenas distribuidas por todo el cuerpo.
Rudimentos germinales posteriores a la ventosa
ventral. Vesícula excretora
en forma de “Y”, con brazos cortos que no llegan al borde
posterior de la ventosa
ventral. Se observaron cuatro
pares de células
flamígeras. En la base de la cola presentan
un par de bolsas caudales
de gruesas paredes con 5-6 espinas.
Cola simple, 165 (125-187), con tegumento
sin espinas y sin velo natatorio.
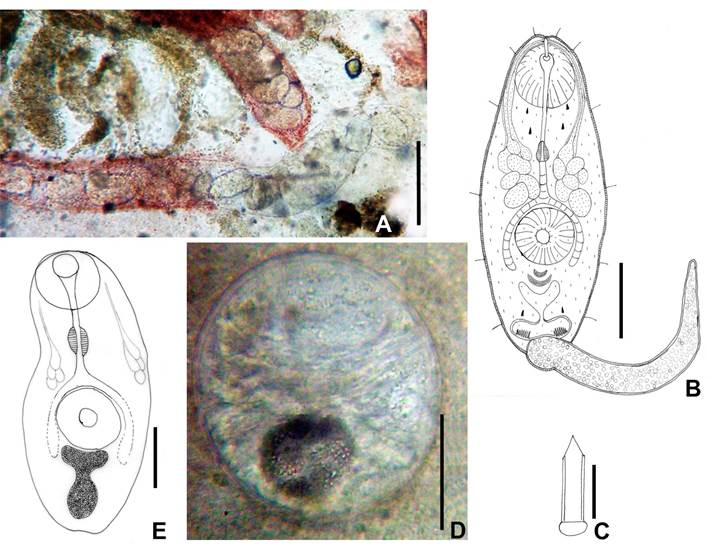
Figura 3. Cf. Cephalogonimus sp.
A. Esporoquiste in vivo de infección natural de Biomphalaria tenagophila. B. Cercaria. C. Detalle del estilete. D. Quiste in vivo 2 días PE en renacuajo. E. Metacercaria 2 días PE. Escala
A: 100 µm; B, D, E:
50 µm; C: 10 µm.
Comportamiento: Las cercarias emergen preferentemente durante la noche. Nadan activamente
con el cuerpo y cola curvados
en forma de “U”. Viven por un período de 48 h. Muestran
fototaxismo negativo.
Infecciones experimentales: Se expusieron cercarias a renacuajos de Rhinella arenarum, Leptodactylus sp. y Pleurodema borellii. Se recuperaron numerosas metacercarias de la cavidad
branquial y tejidos
que rodean la boca.
En un metamorfo expuesto
a xifidiocercarias disecado
a 10 días PE se observaron más de 80 metacercarias maduras
entre los pulmo- nes en formación y en la cavidad visceral. Las cercarias expuestas a ejemplares de gasterópodos Gundlachia concéntrica (Ancylidae) y Physa acuta (Physidae) se enquistaron en el pie. Las cercarias expuestas a larvas de dípteros
y de efemerópteros y a ejemplares de B. tenagophila no penetraron en ellos.
Metacercarias (Fig. 3D): N=10. Quistes obtenidos
experimentalmente 6 días PE casi esféricos, 120 (115-125)
x 107 (93-115), de pared delgada;
en las metacercarias recién enquistadas y durante un día PE se distingue
aún el estilete. A 2 días PE los quistes están maduros, no se distingue el estilete y la vesícula
excretora se observa de forma redondeada y llena de gránulos oscuros;
en las metacercarias desenquistadas se distingue la vesícula excretora con forma de “Y”, con un tronco grueso y corto que se bifurca en dos brazos
también cortos y gruesos.
Infecciones experimentales. Las
metacercarias maduras obtenidas experimentalmente en renacuajos Leptodactylus sp. se proporcionaron a 10 ejemplares
de mojarras (Astyanax
spp. y Bryconnamericus thomasi), 2 anguilas
juveniles (Synbranchus marmoratus), 1 pez dorado (Carassius auratus), 2 madrecitas (Jenynsia sp.) 4 sapos juveniles y 1 adulto
(Rhinella arenarum), 4 patitos (A. platyrhinchos), 2 pollitos
(Gallus domesticus) y 5 ratones (Mus
musculus). No se recuperaron adultos
en ninguno de los animales
expuestos.
Comentarios.
En Argentina se han descripto xifidiocercarias que emergen
de pulmonados (Ostrowski de Núñez 1974, 1983, Ostrowski
de Núñez et al., 1991, Martorelli, 2003) pero difieren
de la aquí descripta en características
morfológicas (tamaño, presencia de espinas,
velo natatorio y forma del estilete)
y eto-ecológicas (ritmo de emergencia, comportamiento en el agua y hospedadores intermediarios secundarios).
En consonancia con la utilización de larvas
de anfibios como segundos
hospedadores intermediarios, podría postularse que estas
xifidiocercarias pertenecen a la familia Cephalogonimidae, que contiene
digeneos parásitos del tracto digestivo de peces,
anfibios y reptiles de América, África y Asia cuyos adultos son pequeños, con espinas y con vesícula
excretora en forma de “Y” (Jones & Bray, 2008), caracteres compartidos con las cercarias y metacercarias aquí descriptas. El género Cephalogonimus cuenta con ciclos dilucidados experimentalmente de C. americanus y C. vesicaudus, ambas registradas en América
del Norte y que utilizan gasterópodos pulmonados Helisoma y renacuajos como primer y segundo
hospedador intermediario y anfibios adultos y
tortugas como hospedadores definitivos, respectivamente. Los esporoquistes y cercarias tienen una organización
similar a los aquí encontrados,
aunque difieren en tamaño, al igual que las metacercarias, que son más grandes en las especies
de América del Norte, ubicándose
en las vísceras (C. americanus) y en la piel (C. vesicaudus) (Lang, 1968, Dronen & Underwood, 1977). La semejanza morfológica, morfométrica y en el uso de los hospedadores intermediarios permiten identificar
provisoriamente a las larvas encontradas en Salta como cf. Cephalogonimus
sp., aunque se requiere el análisis de secuencias genéticas para corroborarlo.
DISCUSIÓN
Las
descripciones de cercarias y otros estadios larvales de trematodes digeneos
aquí realizadas contribuyen al conocimiento de ciclos vitales alogénicos que se desarrollan en el noroeste
argentino. Resta la secuenciación de marcadores moleculares y su comparación con datos de Drepanocephalus, Neopetasiger, Cephalogonimus y
géneros filogenéticamente cercanos publicados en GenBank para complementar
las caracterizaciones morfológicas; es necesaria
además la búsqueda
de los adultos en aves de la zona para establecer los vínculos entre éstos y los estadios larvales.
La familia Echinostomatidae ha sido estudiada con un enfoque
integrativo por Tkach et
al. (2016), dando
como resultado una reubicación de géneros y subfamilias que aporta claridad
en el ordenamiento sistemático; así, las especies de Petasiger y Neopetasiger han
sido reordenadas, ya que el subgénero Neopetasiger, erigido por Bashkirova en 1941, ascendió a género para agrupar
echinostomátidos con 19 espinas, cantidad que presentan las cercarias
aquí descriptas; por otra parte han clarificado el estatus de Drepanocephalus junto al trabajo de Pinto et al. (2015), quienes abordan la descripción
de dos especies de este género en América del Sur, también con un enfoque
integrativo. El estudio
de las xifidiocercarias resultó
dificultoso dada su muy baja prevalencia y debido
a la complejidad de sus estructuras, pequeño tamaño, cortísimo
tiempo de vida y
alta motilidad, como también lo explican Shchenkov et
al. (2022); pese a ello
fue posible su asignación a la familia Cephalogonimidae y, con cierta probabilidad, a Cephalogonimus sp. por las características morfológicas y ecológicas compartidas entre las larvas
analizadas en este trabajo y las de 2 especies con ciclos experimentales dilucidados por Lang (1968) y Dronen & Underwood (1977); estudios
moleculares probablemente podrían indicar que se trata de una especie diferente a las reportadas para América
del Norte.
CONCLUSIÓN
Las
descripciones de la biología de las larvas de 3 taxones de trematodes plagiórquidos asociados a los moluscos planórbidos B. tenagophila y B. orbignyi
en 3 ambientes dulceacuícolas de Salta aportan al conocimiento de la diversidad de helmintos parásitos
de fauna silvestre de la región
Neotropical. Futuros estudios
empleando marcadores moleculares serán de utilidad para establecer las especies a las que pertenecen
las larvas aquí descriptas. El presente trabajo mejora el conocimiento sobre las interacciones que se desarrollan en las comunidades acuáticas de la zona, caracterizando el comportamiento de las larvas e identificando
asociaciones parásito-hospedador.
AGRADECIMIENTOS
Al Consejo de Investigación de la Universidad Nacional de Salta por los subsidios
otorgados, a la Facultad de Ciencias Naturales por el apoyo, a
Daniel Paredes por su acompañamiento
en los muestreos, a Carolina
Davies por la lectura
crítica del manuscrito, a la editora de la revista
y equipo y a los revisores por sus valiosas sugerencias.
REFERENCIAS
Blasco-Costa, I., Cutmore, S. C., Miller, T. L., & Nolan, M. J. (2016).
Molecular approaches to trematode
systematics: ‘best practice’
and implications for future study. Systematic Parasitology, 93(3), 295–306. https://doi. org/10.1007/s11230-016-9631-2
Blasco-Costa, I., & Poulin, R. (2017).
Parasite life-cycle studies: a plea to resurrect an old parasitological tradition. Journal of Helminthology, 91(6), 647-656. https://doi. org/10.1017/S0022149X16000924
Benesh, D. P. (2016).
Autonomy and integration in complex parasite life cycles. Parasitology, 143(14), 1824-1846. https://doi.org/10.1017/S0031182016001311
Bush, A. O., Lafferty, K. D., Lotz, J. M., & Shostak, A. W. (1997). Parasitology meets ecology on its own terms: Margolis et al., Revisited. Journal of Parasitology, 83, 575-583.
Bush, A. O., Fernandez, J. C., Esch, G. W., & Seed, J. R. (2001). Parasitism: The diversity
and ecology of animal parasites. (1º Ed). Cambridge University Press. United Kingdom.
Choudhury, A., Aguirre-Macedo, M. L., Curran, S. S., Ostrowski de Núñez, M., Overstreet, R. M., Pérez-Ponce de León, G. & Portes Santos, C. (2016). Trematode diversity
in freshwater fishes
of the Globe II: “New World”.
Systematic Parasitology, 93(3), 271–282. https://doi.org/10.1007/s11230-016-9632-1
Cribb, T. H., Bray, R. A., Olson, P. D., & Littlewood, D. T. (2003).
Life cycle evolution in the Digenea: a new perspective from phylogeny.
Advances in Parasitology, 54, 197–254.
https://doi.org/10.1016/s0065- 308x(03)54004-0
Drago, F. B., & Lunaschi, L. I. (2011). Digenean parasites of Ciconiiform birds
from Argentina. Revista
Mexicana de Biodiversidad, 82(1), 77-83.
https://doi.org/10.22201/ ib.20078706e.2011.1.374
Drago,
F.
B., Lunaschi, L. I., & Draghi, R. (2014). Digenean
fauna in raptors from northeastern Argentina, with the description of a new species
of Strigea (Digenea: Strigeidae). Zootaxa, 3785, 258–270.
https://doi. org/10.11646/zootaxa.3785.2.8
Dronen, N. O., & Underwood, H. T. (1977). The Life Cycle of Cephalogonimus vesicaudus (Digenea: Cephalogonimidae) from Trionyx
spiniferus from
Texas. Proceedings of the Helminthological Society, 44(2), 198-200.
Esch, G. W., Kennedy,
C. R., Bush, A. O., & Aho, J. M. (1988). Patterns in helminth communities in freshwater fish in Great Britain:
alternative strategies for colonization. Parasitology, 96, 519–532.
https://doi.org/10.1017/ s003118200008015x
Faltýnková, A., Gibson D. I., & Kostadinova A. (2008).
A revision of Petasiger Dietz, 1909 (Digenea: Echinostomatidae) and a key to its species. Systematic Parasitology, 71, 1–40. https://doi.org/10.1007/s11230-008-9146-6
Faltýnková, A., Nasincová, V., & Kablásková, L. (2008). Larval trematodes (Digenea) of planorbid snails (Gastropoda: Pulmonata) in Central Europe:
a survey of species and key to their identification. Systematic Parasitology, 69(3), 155–178. https://doi.org/10.1007/ s11230-007-9127-1
Galaktionov, K. V., & Dobrovolskij, A. A. (2003).
The biology and evolution
of trematodes: an essay on the biology,
morphology, life cycles,
transmissions, and evolution of digenetic trematodes (1º Ed.), KAP. United Kingdom.
Hamann, M. I., Fernández, M. V., & González, C. E. (2019). Metacercariae of Strigeidae Parasitizing Amphibians of the Chaco Region in Argentina. Anais da Academia Brasileira de Ciencias, 91(1), e20180044. https://doi.org/10.1590/0001-3765201920180044
Huguenin, A., Depaquit, J., Villena,
I., & Ferté, H. (2019).
MALDI-TOF mass spectrometry: A new tool for rapid identification of cercariae
(Trematoda, Digenea). Parasite. 26,11. https://doi.org/10.1051/parasite/2019011
Jones, A., & Bray, R. (2008). Family Cephalogonimidae Looss, 1899. En: R. A. Bray, D. I. Gibson,
& A. Jones (Eds.), Keys
to the trematoda.
Volume 3 (pp. 331-337). CABI Publishing and the Natural History Museum. United Kingdom. https://doi. org/10.1079/9780851995885.0331
Lang, B. Z. (1968).
The life cycle of
Cephalogonimus americanus Stafford, 1902 (Trematoda: Cephalogonimidae). Journal of Parasitology, 54, 945-949.
López-Jiménez, A., González-García, M. T., Andrade-Gómez, L., & García-Varela, M. (2023).
Phylogenetic analyses
based on molecular
and morphological data reveal a new species of Strigea Abildgaard, 1790 (Digenea: Strigeidae) and taxonomic changes
in strigeids infecting Neotropical birds
of prey. Journal of Helminthology, 97, e35, 1–15.
https://doi.org/10.1017/S0022149X23000196
Lunaschi, L. I., & Drago, F. B. (2009). Digenean
parasites of six species of birds from Formosa
Province, Argentina. Revista
Mexicana de Biodiversidad, 80(1), 39-46.
https://doi. org/10.22201/ib.20078706e.2009.001.581
Lunaschi, L. I., &
Drago, F. B. (2010). A new species of Petasiger
(Digenea, Echinostomatidae) parasitizing Podiceps
major and Rollandia rolland (Aves, Podicipedidae)
from Buenos Aires Province,
Argentina. Acta
Parasitologica, 55, 230–234.
https://doi. org/10.2478/s11686-010-0033-3
Lunaschi L., & Drago, F. (2012).
Digenean parasites of Cariama cristata (Aves,
Gruiformes) from Formosa
Province, Argentina, with the description of a new
species of the genus Strigea. Acta
Parasitologica, 57(1), 26–33. https://doi.org/10.2478/s11686-012-0004-y
Martorelli, S. R. 2003. Manual de reconocimiento de cercarias, con una introducción al conocimiento de los Digeneos. Cercarias parásitas de Biomphalaria spp. en el área de influencia de la represa de Salto Grande.
Universidad Nacional de La Plata. Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).
Argentina. http:// sedici.unlp.edu.ar/handle/10915/30496
Merlo, M. J., Parietti, M., Fernández, M. V., Flores, V.,
& Davies,
D. (2022). A checklist of larval Digenea (Platyhelminthes: Trematoda) in molluscs from inland waters of Argentina: one hundred years of
research. Journal of Helminthology, 96, e32. https://doi. org/10.1017/S0022149X2100081X
Monasterio de Gonzo, G., P. M. Palavecino, &
Mosqueira, M. E. (2008). Vertebrados y ambientes de la provincia de Salta. EUNSa.
Argentina.
Niewiadomska, K. (2002). Family Strigeidae Railliet, 1919. En: D. I. Gibson,
A. Jones & R. A. Bray (Eds.), Keys
to the trematoda.
Volume 1 (pp. 231-242) CABI Publishing and The Natural History Museum. United Kingdom.
Nasincová, V., Scholz, T.
& Moravec,
F. (1994). Redescription of Petasiger exaeretus Dietz, 1909
and P. phalacrocoracis (Yamaguti, 1939)
(Trematoda: Echinostomatidae), parasites of cormorants. Systematic Parasitology, 27:139- 147. https://doi.org/10.1007/BF00012272
Nasir, P., G. González T.
& Díaz, M. T. (1972).
Freshwater larval Trematodes. XXX. Life cycle of Petasiger
novemdecim Lutz, 1928. Proceedings of the Helminthological Society
of Washington, 39(2),
162-168.
Nassi, H. (1980). Données expérimentales sur le cycle
biologique de Petasiger caribbensis n. sp. (Trematoda: Echinostomatidae) parasite larvaire
de Biomphalaria glabrata en Guadeloupe. Annales de Parasitologie, 55(1), 41-55.
Nolan, M. J., & Cribb, T.
H. (2005). The use and implications of ribosomal DNA sequencing for the discrimination of digenean species. Advances in Parasitology, 60, 101–163. https://doi.org/10.1016/S0065-308X(05)60002-4
Olson, P. D., & Tkach,
V. V. (2005).
Advances and trends in the molecular
systematics of the
parasitic Platyhelminthes. Advances in Parasitology, 60, 165–243.
https://doi. org/10.1016/S0065-308X(05)60003-6
Ostrowski de Núñez, M. (1968).
Estudios sobre la fauna parasitaria del biguá, Phalacrocorax o. olivaceus. I. Trematodes pertenecientes a las familias Cathaemasidae y Echinostomatidae. Revista del Museo Argentino
de Ciencias Naturales B. Rivadavia, Serie Parasitología, I (2),131-152.
Ostrowski de Núñez, M. (1974). Fauna de agua dulce de la República Argentina. III. Cercarias de la superfamilia Plagiorchioidea (Trematoda). Neotropica, 20(62), 67-72.
Ostrowski de Núñez, M. (1977).
Fauna de agua dulce de la República Argentina. VIII. Furcocercarias
(Trematoda) nuevas de moluscos de las familias Planorbidae y Ancylidae. Physis, 37,117-125.
Ostrowski de Núñez, M., Hamann, M. I. & Rumi, A. (1997). Estudios
de trematodes larvales
en Biomphalaria spp. (Mollusca, Planorbidae) de la localidad de San Roque, provincia
de Corrientes, Argentina. Physis, 54, 7-15.
Ostrowski de Núñez, M. (1983).
Trematodos larvalesdeVenezuela.Cercarias
pertenecientes a la superfamilia Plagiorchioidea. Anales
del Instituto de Biología, 53(1), 27-38.
Ostrowski de Núñez, M., Hamann, M. I., & Rumi, A. (1991). Population dynamics of planorbid snails from a lenitic biotope in northeastern Argentina. Larval trematodes of Biomphalaria occidentalis and analysis of their prevalence and seasonality. Acta Parasitologica Polonica, 36 (4), 159-166.
Ostrowski de Núñez, M. (1992).
Trematoda. Familias Strigeidae, Diplostomidae, Clinos-
tomidae, Schistosomatidae, Spirorchiidae y Bucephalidae. En: Z. A. de Castellanos (Ed.), Fauna de agua dulce de la República
Argentina. Volumen 9 Fascículo
1 (pp. 5-55). PROFADU
(CONICET).
Pinto, H. A., Mahecha, G. A., & de Melo, A. L. (2013).
Petasiger Dietz, 1909 (Trematoda: Echinostomatidae) in birds and mollusks from Brazil. Revista Brasileira de Parasitologia
Veterinaria = Brazilian journal
of veterinary parasitology, 22(3), 427–432. https://doi. org/10.1590/S1984-29612013000300019
Pinto, H. A., Griffin,
M. J., Quiniou, S. M., Ware, C., & Melo, A. L. (2016).
Biomphalaria straminea
(Mollusca: Planorbidae) as an intermediate host of Drepanocephalus spp. (Trematoda: Echinostomatidae) in Brazil: a morphological
and molecular study. Parasitology Research, 115(1),
51–62. https:// doi.org/10.1007/s00436-015-4469-0
Poulin, R. (2010).
The scaling of dose with host body mass and the determinants of success in experimental cercarial infections. International
Journal for Parasitology, 40 (3), 371-377. https://doi.org/10.1016/j. ijpara.2009.09.001
Ruiz, J. M. (1952).
Contribuição ao estudo
das formas larvárias de trematóides brasileiros. 3. Fauna de Belo Horizonte e Jaboticatubas, Estado de Minas Gerais. Memórias do Instituto Butantan, 24, 45-62.
Shchenkov, S., Denisova, S., Nesterenko, M., Lebedenkov,
V.,
& Kharytonau, D. (2022). Morphological description and phylogenetic position
of xiphidiate cercaria of Prosthogonimus pellucidus
(Trematoda: Digenea), 19, 425-432. https://doi. org/10.15298/invertzool.19.4.06
Tkach, V. V., Kudlai, O., & Kostadinova, A. (2016).
Molecular phylogeny and systematics of the Echinostomatoidea Looss,
1899 (Platyhelminthes: Digenea). International Journal for Parasitology, 46(3),
171–185. https://doi.org/10.1016/j.ijpara.2015.11.001
Toledo, R., Esteban,
J. G., &
Fried, B. (2009). Chapter
3. Recent advances
in the biology of echinostomes. Advances in Parasitology, 69, 147–204.
https://doi.org/10.1016/S0065-308X(09)69003-5
Yamaguti, S. (1971). Synopsis of digenetic trematodes of vertebrates. Vol I y II. (1º Ed.). Keigaku Publishing Co. Japan.
Zamparo, D., Overstreet, R. M, & Brooks, D. R. (2005).
A new species of Petasiger
(Digenea: Echinostomiformes: Echinostomatidae) in the brown pelican,
Pelecanus occidentalis, (Aves: Pelecaniformes: Pelecanidae), from the area de conservación Guanacaste, Costa Rica. Journal
of Parasitology, 91(6), 1465- 1467. https://doi.org/10.1645/GE-3483.1
& Margarita Ostrowski de Núñez†